|
Sie sind hier: Startseite » Ausgewählte Arbeiten

Eisberg im Los Glaciares National Park © Marianocecowski
Was ist eigentlich eine Anomalie?
Laut Duden ist eine Anomalie eine Abweichung vom Normalen, oder auch Abnormität genannt. Über die Anomalie des Wassers sagt der Duden:
Das unregelmäßige Verhalten des Wassers bei Temperaturänderungen im Vergleich mit den meisten anderen Stoffen!
Auf dieses Phänomen wollen wir im Folgenden weiter eingehen, und es genauer untersuchen:
Normalerweise dehnen sich Stoffe bei Erwärmung aus und ziehen sich bei Abkühlung wieder zusammen. Im Gegensatz dazu dehnt sich Wasser bei der Erwärmung nicht immer aus. Wasser besitzt bei 4°C (also 277,16 K) seine größte Dichte. Zwischen 0°C und 4°C zieht es sich bei Erwärmung zusammen, erst oberhalb von 4°C dehnt es sich aus, was in der nachstehenden Grafik verdeutlicht wird:
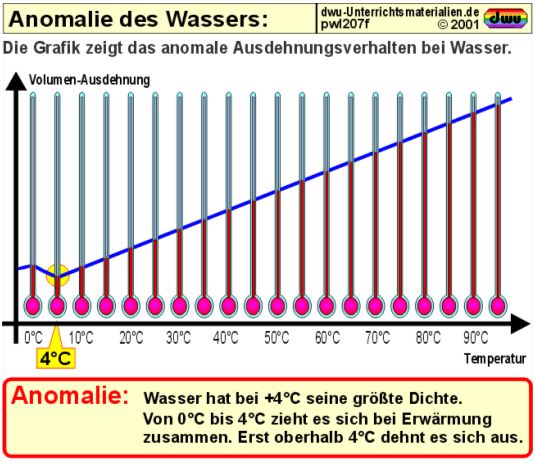
Aus diesem Grund stellen wir uns die Frage, ob sich Wasser überhaupt als Flüssigkeit in einem Thermometer eignet?
Ließe sich Wasser in einem Thermometer verwenden?
|
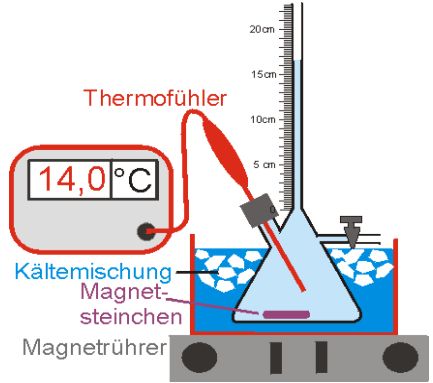
Mit dem dargestellten Versuch untersuchen wir die Volumenausdehnung von Wasser bei Abkühlung von ca. 14°C auf 0°C.
Das Wasser wurde so eingefüllt, dass sich keine Luftblasen mehr im Kolben befinden. Die Wassertemperatur im Kolben wird mit einem Thermoelement gemessen.
Der Kolben wird in eine Kältemischung aus Eis, Wasser und Salz gestellt.
Mit dem Magnetrührer wird das Magnetsteinchen in Rotation versetzt.
Nun wird die Steighöhe h(ϑ) in Abhängigkeit von der Temperatur ϑ während der Abkühlphase gemessen.
|
 |
Ergebnis:
Wasser ist nicht als Flüssigkeit in einem Thermometer geeignet. Denn es würde oft die Temperatur nicht eindeutig anzeigen, da Wasser bei z. B. 1°C und 7°C die gleiche Ausdehnung hat.
Anomalie in der Natur
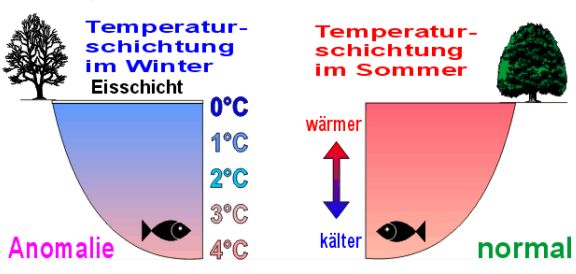
Diese unregelmäßige Wärmeausdehnung ist die Ursache dafür, dass tiefere Seen auch im strengen Winter nicht auf den Grund zufrieren, und so das Überleben der Fische gesichert ist.
Bedeutung der Anomalie in der Natur:
Die Temperaturschichtung eines entsprechend tiefen Sees ist im Winter so, dass die Fische in "Winterstarre" überleben können.
Neben dem Dichtemaximum bei 4°C wird oft auch die Tatsache als Anomalie bezeichnet, dass beim Übergang vom flüssigen Wasser in den festen Zustand (Eis) die Dichte sprunghaft ab- und das Volumen um fast 10% zunimmt!
Die Begründung dafür: Beim Gefrieren bildet sich ein weitmaschiges, mit zahlreichen Hohlräumen durchsetztes Kristallgitter, das mehr Platz einnimmt, als die isoliert nebeneinander liegenden Einzelmoleküle!
Wasserstoffbrückenbildung
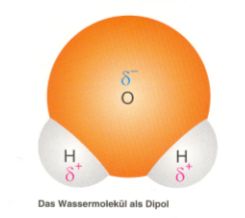
Durch die unterschiedlichen Partialladungen -bestehend aus dem partial negativ geladenen Sauerstoffatom und den partial positiv geladenen Wasserstoffatomen- innerhalb eines Wassermoleküls ist dieses ein Dipol (ein negativer und ein positiver Pol an lokal unterschiedlichen Orten innerhalb des Moleküls). Da sich gleiche Ladungen abstoßen und unterschiedliche Ladungen anziehen, richten sich die Moleküle in gewissen Mustern an. Diese Bindungen der Moleküle untereinander nennt man Wasserstoffbrückenbindung. Diese Wasserstoffbrückenbindung ist verantwortlich für die Oberflächenspannung und den Aggregatzustand bei Raumtemperatur.
Besteht ein Stoff aus Dipolmolekülen, so sind die elektrostatischen Anziehungskräfte groß und seine Schmelz- und Siedetemperaturen liegen bedeutend höher.
Bei Wasser ist dieser Effekt besonders ausgeprägt. Seine Molekülgröße ließe eine Siedetemperatur von ungefähr +70°C erwarten, tatsächlich siedet es jedoch bei +100°C!

Vergleich der Eigenschaften von Wasser und Kerzenwachs:
Mit den erlangten Erkenntnissen betrachten wir nun das nächste Experiment:
Wir geben eine Kerze in flüssiges Kerzenwachs und beobachten, dass die Kerze untergeht.
Dann geben wir einige Eiswürfel in Wasser und stellen fest, dass sie an der Oberfläche schwimmen und nicht untergehen.
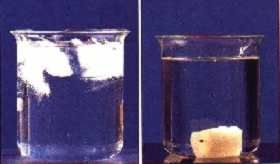
Das Bild zeigt links einen Eiswürfel in Wasser
und rechts eine Kerze in flüssigem Kerzenwachs
Was können wir nun über diese Beobachtung sagen?
Wir wissen, dass sich Stoffe in der Regel bei Erwärmung ausdehnen und somit eine geringere Dichte haben als im festen Zustand. Das erklärt, warum die feste Kerze im flüssigen Wachs untergeht.
Das gefrorene Wasser hingegen hat eine geringere Dichte als das flüssige und schwimmt somit oben.
« zurück zur Übersicht "Phänomen Wasser"
« zurück zur Übersicht Projekte - Ausgewählte Arbeiten
Startseite |
Projekte |
Schirmherrschaft |
Sponsoren |
Impressum
|